-
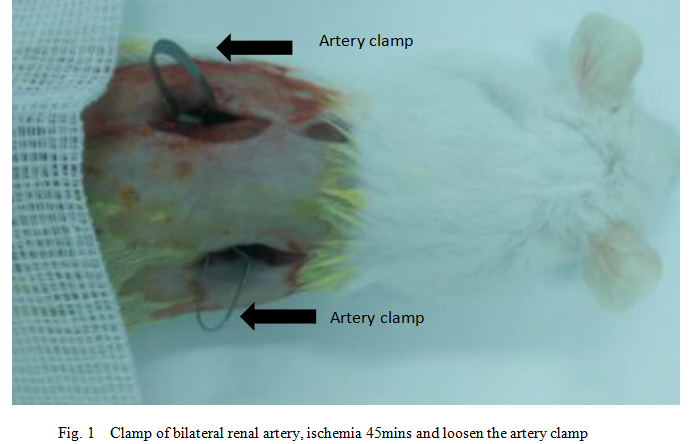 Fig 1.Clamp of bilateral renal artery,ischemia 45 mins and loose
Fig 1.Clamp of bilateral renal artery,ischemia 45 mins and loose
-
 产品包装(模拟)
产品包装(模拟)
-
 产品包装(模拟)
产品包装(模拟)
-
 通过ISO 9001、ISO 13485质量体系认证
通过ISO 9001、ISO 13485质量体系认证
肾缺血再灌注损伤(RIRI)小鼠模型
Mouse Model for Renal Ischemia-Reperfusion Injury (RIRI)
- 编号DSI529Mu01
- 物种Mus musculus (Mouse,小鼠)
- 下载 英文说明书 中文说明书
- 规格 每例
- 价格 ¥ 1200
基础信息
- 原型物种人
- 来源缺血再灌注,双侧肾动脉夹闭法
- 模式动物品系Balb/c小鼠,SPF级,雄性,周龄:4~6周,体重:20g~22g
- 实验分组随机分组:对照组,模型组,阳性药物组,受试药物组(3个浓度梯度组),15只每组
- 实验周期24h、72h
- 建模方法1 选取20-22g左右小鼠,术前禁食12h,自由饮水。
2 3%戊巴比妥钠(80mg/kg)腹腔注射麻醉,小鼠背部去毛,消毒备皮。
3 在背部脊椎旁0.5cm、肋骨下缘0.5cm处剪开皮肤及肌肉,可见到肾脏, 小心分离出两侧肾脏的肾动脉,迅速用动脉夹夹闭两侧肾动脉。
4 缺血45min后松开动脉夹,恢复血流,观察肾脏恢复情况。
5 分两层缝合开口,待小鼠清醒后,将其放回洁净笼具后放回饲养室饲养,定期观察小鼠状态及死亡情况并做好记录。
6 对照组不做缺血处理,其他操作相同。
7 分别取再灌注0h、3h、6h、12h、24h、72h六个时间点取材。麻醉小鼠,摘眼球取血,室温静置2h后于4℃3000r离心10分钟提取血清,放入-80冰箱冻存。同时取左肾组织留作病理标本,右肾组织分生标本。 - 应用可用于研究肾缺血再灌注损伤在临床预防和治疗中的作用
模型评价
1. 血清生化指标检测:
取各时间点(0h、1h、3h、6h、12h、24h、72h)血清,检测血清BUN(尿素氮)和Scr(血肌酐)水平,评估肾功能。
2. 肾系数检测:
摘取双侧肾脏后,生理盐水冲洗,称重计算肾系数。
肾系数=双侧肾重(mg)/体重(g)
3.肾小管坏死的评分:
每张切片×200 倍镜下取外髓质部 10 个视野,按
0 = 正常,1 = 轻微损伤(受损肾小管< 5%),
2= 轻度损伤(受损肾小管 5 %~25 %),
3 = 中度损伤(受损肾小管 25 %~75 %) ,
4 = 重度损伤(受损肾小管> 75 %) 作半定量分析并计算其均值,作为肾小管坏死的评分指数。
组织病理学
4%多聚甲醛溶液固定48h。常规组织脱水、透明、浸蜡 、包埋。石蜡切片进行HE染色和PAS染色。
对照组小鼠肾小球、 肾小管及肾间质结构基本正常。在 模型组组, 随着再灌注时间的延长呈现不同程度的肾脏病理改变, 可见肾小管上皮细胞浑浊肿胀,出现水样或空泡变性,刷状缘消失,部分肾小管上皮细胞凝固性坏死、脱落,腔内可见管型,并可见间质水肿,间质内灶性炎症细胞浸润,肾小球病变不明显。
标志因子水平
ELISA 法检测血清 TNF-α、IL-6 含量, 模型组小鼠血清 TNF- α 和 IL- 6 含量在各时间点均显著高于对照组,其中24h为最显著。
统计学分析
应用SPSS软件进行统计分析,计量资料以均数±标准差(x ±s)表示,采用t检验,组间比较采用单因素方差分析,P<0.05表示有显
资质许可






留言板
如果您有任何问题,请留言,我们将最快在24小时内给您回复。
立即留言
