-
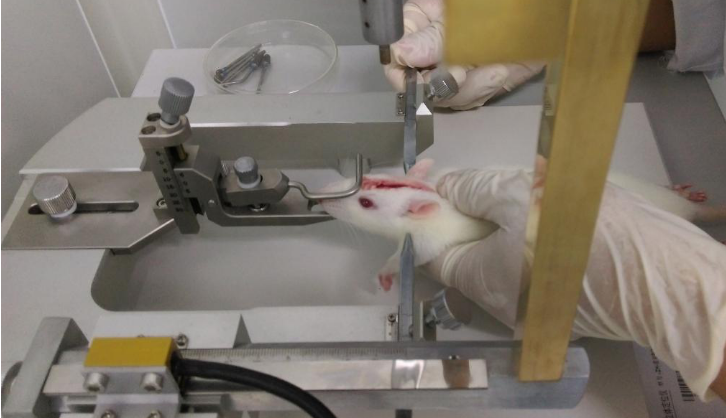 Fig. Operation of Traumatic Brain Injury
Fig. Operation of Traumatic Brain Injury
-
 产品包装(模拟)
产品包装(模拟)
-
 产品包装(模拟)
产品包装(模拟)
-
 通过ISO 9001、ISO 13485质量体系认证
通过ISO 9001、ISO 13485质量体系认证
颅脑损伤(TBI)大鼠模型
Rat Model for Traumatic Brain Injury (TBI)
- 编号DSI538Ra01
- 物种Rattus norvegicus (Rat,大鼠)
- 下载 英文说明书 中文说明书
- 规格 每例
- 价格 ¥ 1200
基础信息
- 原型物种人
- 来源颅脑打击致颅脑损伤
- 模式动物品系SPF级SD大鼠,健康,雄性,体重为180g~200g
- 实验分组实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。
- 实验周期7d
- 建模方法1. 称量大鼠,腹腔麻醉,头部正中剃毛后用碘酒及酒精擦拭手术区域。
2. 沿头部正中稍偏右切开头皮约2cm,钝性分离软组织及骨外膜后暴露颅骨,在人字缝前方2 mm,颅骨中线旁2 mm,用颅骨钻打开直径为4 mm的圆形骨窗,保持硬脑膜完好无损,采用自由落体撞击至脑挫伤的方法。
3. 用一个40g的金属重物自25cm高处垂直坠落,撞击置在硬脑膜上的圆柱体,致伤冲击力为 1000g·cm造成右顶叶脑挫裂伤,致伤面积为4mm×4mm,致重度脑损伤,然后用骨蜡封闭骨窗,缝合头皮。
4. 待大鼠苏醒后自由饮水,正常饲养。
5. 对照组仅作右顶叶相应部位颅骨开窗,不致伤。
样本采集:
1.血液标本留取:分别于术后24h、72h及7d水合氯醛麻醉大鼠后,于下腔静脉取血2ml,室温静置2h后于4℃ 3000r离心10分钟提取血清,放入-80冰箱冻存。
2.脑组织标本留取:取脑后用4%多聚甲醛溶液固定,蔗糖溶液脱水后,经OCT包埋做冰冻切片,切片10um。 - 应用疾病模型
模型评价
1.神经行为学评分(mNSS评分):共记录3天
提尾实验;(0-3分)
将大鼠放置于地板上观察行走状况;(0-3分)
感觉实验;(0-2分)
平衡木实验;(0-6分)
反射丧失和不正常运动实验;(0-4分)
2.Morris水迷宫
颅脑损伤后大鼠的神经功能受到损伤,认知能力也会受到影响。术后应用Morris水迷宫对各组大鼠进行为期6天的训练后开始实验。
3.脑含水量检测:
需要独立的脑组织完成检测,不可与其他检测共用样本,;
采用干湿重比。分离出脑实质(丢弃嗅球和小脑后),沿中线将其分为两个大脑半球:同侧(右)和对侧(左)。 立即称重大脑样品以获得湿重(WW),然后使用干燥炉在110°C下干燥24小时以获得干重(DW)。 水含量的计算公式如下:水含量(%)=(WW–DW)/ WW×100%。
组织病理学
神经细胞凋亡(TUNEL)
脑组织石蜡包埋,切片,进行TUNEL染色,对切片进行荧光全景扫描。
TBI 会产生大量的细胞凋亡。凋亡是发生在多细胞有机体中的一种程序性的细胞死亡过程,其中多种生化过程会引起细胞特征性的改变,特别是形态学上的改变,最后导致细胞死亡。用TUNEL法检测细胞凋亡。
标志因子水平
ELISA检测:分离血浆,ELISA检测血浆中von Willebrand factor、LBP (Lipopolysaccharide-binding protein)、Serpina3n的表达。
统计学分析
应用SPSS软件进行统计分析,计量资料以均数±标准差(x ±s)表示,采用t检验,组间比较采用单因素方差分析,P<0.05表示有显
资质许可






留言板
如果您有任何问题,请留言,我们将最快在24小时内给您回复。
立即留言
